Як працюють настінні годинники, пульт від телевізора чи дитяча іграшка на радіокеруванні? Більшість людей, не замислюючись, відповість — «від батарейок» і будуть, в принципі, мати рацію. Але навряд чи хтось з них зможе розповісти, як саме портативний елемент живлення зроблений, яким чином він функціонує і без чого весь процес передачі електричного струму від батареї до кінцевого споживача був би неможливий. Давайте заповнимо цей прикрий пробіл у знаннях.
Принцип роботи батареї
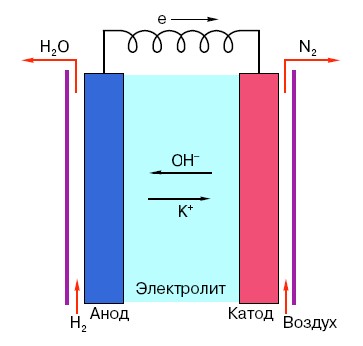
Для того щоб зрозуміти принцип функціонування звичайної «пальчикової» батарейки, необхідно мати загальне уявлення про її будову. Отже, будь-яка батарейка складається з трьох основних елементів — анода, катода і електроліту. При цьому останній може мати фактично будь-який агрегатний стан: вміщені в соляний розчин катод і анод, в принципі, так само є «батарейкою», тільки в незвичному для рядового обивателя вигляді.
Цікаво! Так званий «вольтів стовп», винайдений Алессандро Вольта, так само мав усі необхідні для виробництва електроструму елементи. Він складався з покладених одну на одну цинкових і мідних пластин, між якими в якості «прошарку» містилася змочена в кислоті тканина.
Анод в подібних системах – це головне джерело електронів, які, як ми знаємо зі шкільного курсу фізики, що мають негативний заряд. Негативно заряджені частинки притягуються до позитивних, а в якості «плюса» в даному випадку виступає поверхню катода.
Але для виникнення електроструму цього мало, адже електронам потрібна ще й своєрідна «магістраль» — середовище, яка підтримувала б взаємодію катода і анода. Саме тут на сцені з’являється електроліт – сіль, луг або кислота, здатні проводити струм.
Розглянемо принцип дії на конкретному прикладі: є елемент живлення, розрахований на 18 вольт. Напруга між електродами в ньому стабільно, поки він не включений в мережу. Як тільки з’являється споживач (наприклад, звичайна лампочка), напруга починає поступово знижуватися, від «мінусового» електрода до «плюсового» почне текти струм, і в електроліті відбудеться хімічна реакція, спрямована на підтримання різниці потенціалів між електродами.
Довідка. Чим більше енергії потрібно споживачеві, тим інтенсивніше тече реакція всередині елемента живлення і тим швидше він вийде з ладу.
Як працює акумуляторна батарея, її відмінність від звичайної
Отже, ми розглянули класичні «пальчикові» і «мізинчикові» елементи живлення і знаємо, що термін служби більшості з них суворо обмежений (що б там не говорили імениті виробники). Але як же бути з так званими АКБ – елементами живлення акумуляторного типу, здатними не тільки витрачати енергію в процесі реакції, але й накопичувати її та зберігати протягом довгого часу?
Для того щоб зрозуміти принцип роботи АКБ, необхідно звернутися до хімії. В якості прикладу візьмемо… Звичайний багаття на вугіллі. Як би красиво і заворожуюче виглядало полум’я, будь-хімік, спостерігаючи його, знає, що даний процес являє собою всього лише тривалу реакцію окислення палива. Палаючий вугілля взаємодіє з киснем і як результату такої реакції ми отримуємо:
- вуглекислий газ;
- світло;
- тепло.
І якщо останні два пункти здатні зігріти душу і тіло, то ось як-небудь використовувати вуглекислий газ ми не можемо, адже це побічний продукт реакції, що є, по суті, її відходом. Реакція окислювання припиняється тоді, коли закінчуються вихідні елементи: кисень і вугілля. Зупинка реакції в батарейці відбувається точно так само, коли вихідні речовини повністю вичерпують себе і залишаються тільки «відходи».
В АКБ ж все відбувається трохи не так. Справа в тому, що реакція, що протікає в ній, відноситься до розряду оборотних, тобто при певних умовах її можна «повернути назад», повернувши всі речовини в їх початковий стан. Саме можливість протікання оборотної реакції в акумуляторі дозволяє заряджати його.

В АКБ, підключеній до мережі, реакція протікає у зворотному напрямку, і струм йде від «плюса» і «мінуса», а не навпаки. Як результат – продукт реакції утворює вихідні речовини, а власник АКБ отримує доступну «відновлену» енергію в портативному форматі. От і все!






